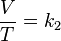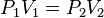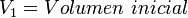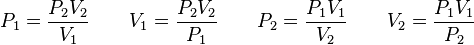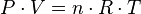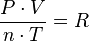CALOR Y TEMPERATURA
¿Que se
llama calor?
Es la transferencia de energía entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas. Este flujo siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia de calor hasta que ambos cuerpos se encuentren en equilibrio térmico.
Es la transferencia de energía entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas. Este flujo siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia de calor hasta que ambos cuerpos se encuentren en equilibrio térmico.
¿En que se mide el calor?
La calorimetría se encarga de medir el calor en una reacción química o un cambio físico usando un calorímetro. La calorimetría indirecta calcula el calor que los organismos vivos producen a partir de la producción de dióxido de carbono y de nitrógeno (urea en organismos terrestres), y del consumo de oxígeno.
¿A que se llama temperatura?
Temperatura: es una medida del calor o energía térmica de las partículas en una sustancia. Como lo que medimos en su movimiento medio, la temperatura no depende del número de partículas en un objeto y por lo tanto no depende de su tamaño. Por ejemplo, la temperatura de un cazo de agua hirviendo es la misma que la temperatura de una olla de agua hirviendo, a pesar de que la olla sea mucho más grande y tenga millones y millones de moléculas de agua más que el cazo.
¿en que se mide la temperatura?
La temperatura se mide con termómetros, los cuales pueden ser calibrados de acuerdo a una multitud de escalas que dan lugar a unidades de medición de la temperatura. En el Sistema Internacional de Unidades, la unidad de temperatura es el kelvin (K), y la escala correspondiente es la escala Kelvin o escala absoluta, que asocia el valor "cero kelvin" (0 K) al "cero absoluto", y se gradúa con un tamaño de grado igual al del grado Celsius. Sin embargo, fuera del ámbito científico el uso de otras escalas de temperatura es común. La escala más extendida es la escala Celsius (antes llamada centígrada); y, en mucha menor medida, y prácticamente sólo en los Estados Unidos, la escala Fahrenheit.
Termómetro:
¿En que consiste un termómetro? ¿Cómo se construye? ¿Cuántas variedades? ¿En que se aplica cada una?
El termómetro es un instrumento de medición de temperatura. Desde su invención ha evolucionado mucho, principalmente a partir del desarrollo de los termómetros electrónicos digitales.
Inicialmente se fabricaron aprovechando el fenómeno de la dilatación, por lo que se prefería el uso de materiales con elevado coeficiente de dilatación, de modo que, al aumentar la temperatura, su estiramiento era fácilmente visible. El metal base que se utilizaba en este tipo de termómetros ha sido el mercurio, encerrado en un tubo de vidrio que incorporaba una escala graduada.
Orales, timpánicos, axilares o rectales, también los hay de mercurio o digitales; la variedad de termómetros es amplia y aunque tienen el mismo objetivo, algunos son más exactos y otros son fáciles de usar.
Hay tres condiciones esenciales para tomar correctamente la temperatura: medirla siempre en el mismo lugar del cuerpo, emplear el mismo termómetro y mantenerlo limpio.
Tipos de Termometros
• Termómetro de mercurio: es un tubo de vidrio sellado que contiene un líquido, generalmente mercurio o alcohol coloreado, cuyo volumen cambia con la temperatura de manera uniforme. Este cambio de volumen se visualiza en una escala graduada. El termómetro de mercurio fue inventado por Fahrenheit en el año 1714.
Calor
El calor es una cantidad de energía y
es una expresión del movimiento de las moléculas que componen un cuerpo.
Cuando el calor entra en un cuerpo se
produce calentamiento y cuando sale, enfriamiento. Incluso los objetos más
fríos poseen algo de calor porque sus átomos se están moviendo. (Ver: Termodinámica, Tercera Ley)
Temperatura
La temperatura es la medida del calor de un cuerpo (y
no la cantidad de calorque este contiene o puede
rendir).

Diferencias entre calor y
temperatura
Todos sabemos que cuando calentamos un
objeto su temperatura aumenta. A menudo pensamos que calor y temperatura son lo
mismo. Sin embargo, esto no es así. El calor y la temperatura están
relacionadas entre sí, pero son conceptos diferentes.
Como ya dijimos, el calor es la energía
total del movimiento molecular en un cuerpo, mientras que la temperatura es la
medida de dicha energía. El calor depende de la velocidad de las partículas, de
su número, de su tamaño y de su tipo. La temperatura no depende del tamaño, ni
del número ni del tipo.
Por ejemplo, si hacemos hervir agua en
dos recipientes de diferente tamaño, la temperatura alcanzada es la misma para
los dos, 100° C, pero el que tiene más agua posee mayor cantidad de calor.
El calor es lo que hace que la temperatura
aumente o disminuya. Si añadimos calor, la temperatura aumenta. Si quitamos
calor, la temperatura disminuye.
La temperatura no es energía sino una
medida de ella; sin embargo, el calor sí es energía.

CAMBIOS PROVOCADOS POR EL CALOR



Ley de Charles
La Ley de Charles y Gay-Lussac, o simplemente Ley de Charles, es una de las leyes de los gases. Relaciona el volumen y latemperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética (debido al movimiento) de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos deGuillaume Amontons en 1702.
Por otro lado, Gay-Lussac relacionó la presión y la temperatura como magnitudes directamente proporcionales en la llamada "La segunda ley de Gay-Lussac".
Volumen sobre temperatura: Constante (K -en referencia a si mismo)
ley de Boyle-Mariotte
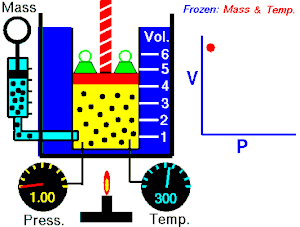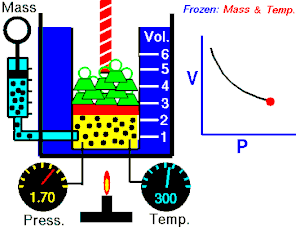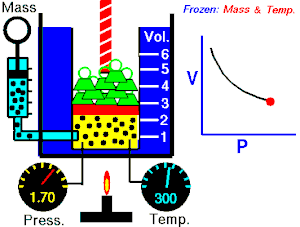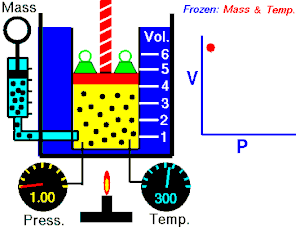
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el físico y químico irlandés Robert Boyle(1662) y el físico y botánico francés Edme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y lapresión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.
o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante  para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:

Ley de Gay-Lussac
Establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
- Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (Kelvin) permanece constante:
o también:
donde:
- P es la presión
- T es la temperatura absoluta (es decir, medida en Kelvin)
- k3 la constante de proporcionalidad
Descripción[editar]
Para una cierta cantidad de gas, al aumentar la temperatura las moléculas del gas ,se mueven más rápidamente y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo, es decir, aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar. Gay-Lussac descubrió que, en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
Supongamos que tenemos un gas que se encuentra a una presión  y a una temperatura
y a una temperatura  al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor
al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor  , entonces la presión cambiará a
, entonces la presión cambiará a  , y se cumplirá:
, y se cumplirá:
 y a una temperatura
y a una temperatura  al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor
al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor  , entonces la presión cambiará a
, entonces la presión cambiará a  , y se cumplirá:
, y se cumplirá:
donde:
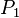 = Presión inicial
= Presión inicial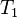 = Temperatura inicial
= Temperatura inicial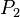 = Presión final
= Presión final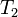 = Temperatura final
= Temperatura final
Que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la ley de Charles, está expresada en función de la temperatura absoluta. Es decir, las temperaturas han de expresarse en Kelvin.
Leyd e los gases ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
En 1648, el químico Jan Baptist van Helmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las génesis características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La principal característica de los gases respecto de los sólidos y los líquidos, es que no pueden verse ni tocarse, pero también se encuentran compuestos de átomos y moléculas.
La causa de la naturaleza del gas se encuentra en sus moléculas, muy separadas unas de otras y con movimientos aleatorios entre si. Al igual que ocurre con los otros dos estados de la materia, el gas también puede transformarse (en líquido) si se somete a temperaturas muy bajas. A este proceso se le denomina condensación.
La mayoría de los gases necesitan temperaturas muy bajas para lograr condensarse. Por ejemplo, en el caso del oxígeno la temperatura necesaria es de -183°C.
Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, aparentemente de manera independiente por August Krönig en 1856 1 y Rudolf Clausius en 1857.2 La constante universal de los gases se descubrió y se introdujo por primera vez en la ley de los gases ideales en lugar de un gran número de constantes de gases específicas descriptas por Dmitri Mendeleev en 1874.3 4 5
La ecuación de estado para gases reales[editar]
| Valores de R |
|---|
 |
 |
 |
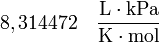 |
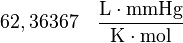 |
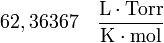 |
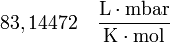 |
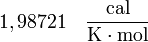 |
 |
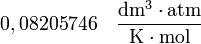 |
Haciendo una corrección a la ecuación de estado de un gas ideal, es decir, tomando en cuenta las fuerzas intermoleculares y volúmenes intermoleculares finitos, se obtiene la ecuación para gases reales, también llamada ecuación de Van der Waals:
Donde:
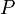 = Presión del gas
= Presión del gas = Volumen del gas
= Volumen del gas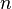 = Número de moles de gas
= Número de moles de gas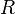 = Constante universal de los gases ideales
= Constante universal de los gases ideales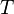 = Temperatura del gas
= Temperatura del gas y
y 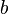 son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
Ecuación general de los gases ideales[editar]
Partiendo de la ecuación de estado:
Tenemos que:
Donde R es la constante universal de los gases ideales, luego para dos estados del mismo gas, 1 y 2:
Para una misma masa gaseosa (por tanto, el número de moles «n» es constante), podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.